La clasificación periodica de los
elementos no tan solo facilita el conocimiento y la descripción de los
elementos químicos, sino que permite el estudio comparativo de sus propiedades,
de sus analogías y diferencias y de sus tendencias y secuencias.
·
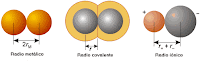
El radio atómico representa
la distancia que existe entre el núcleo y la capa de valencia (la más externa).
Por medio del radio atómico es posible determinar el tamaño del átomo.
En los grupos, el radio atómico aumenta
con el número atómico, es decir hacia abajo.
En los periodos disminuye al aumentar Z,
hacia la derecha, debido a la atracción que ejerce el núcleo sobre los
electrones de los orbitales más externos, disminuyendo así la distancia
núcleo-electrón.
·
Radio Iónico: Es la distancia
entre el centro del núcleo y la orbita electrónica externa del Ion.
Cuando un átomo neutro cede electrones,
transformándose en catión, su radio disminuye. Por el contrario, si un átomo
gana electrones, completando su ultima orbita con ocho electrones, se
transforma en un anión y su radio aumenta. Esto se explica por la repulsión
eléctrica entre los electrones, de modo similar a lo que sucede con los gases
inertes.
·
Potencial de Ionización: Cuando a un
átomo neutro se le quita un electrón se ioniza, transformándose en catión. El
proceso para arrancar un electrón requiere cierta cantidad de energía que se
denomina potencial de ionización y que se puede definir así:
Potencial de ionización es la
energía necesaria para arrancar un electrón de la capa externa de un átomo aislado.
Dentro de cada periodo de la Tabla Periódica, el potencial de ionización
aumenta de izquierda a derecha.
En un mismo grupo de la Tabla Periódica, el
potencial de ionización aumenta de abajo hacia arriba, y en un periodo aumenta
de izquierda a derecha.
Al aumentar el numero atómico se
incrementa el numero de orbitas, y por lo tanto, se reduce la atracción entre el
núcleo y los electrones externos.
·
Afinidad electrónica: En las
propiedades químicas de los elementos, ejerce una considerable influencia la
tendencia de un átomo neutro a capturar electrones para transformarse en anión.
Esta cualidad se mide por la denominada afinidad electrónica, que
se puede definir así: energía que se libera cuando un átomo neutro gana un
electrón.
En general, la afinidad electrónica
varia en la Tabla Periódica de modo análogo al potencial de ionización.
·
Electronegatividad: Es la
capacidad que posee un átomo para atraer al par de electrones que comparte en
una molécula covalente.
Es la capacidad relativa que tiene un
átomo para atraer electrones de una unión química.
Para cada periodo, la electronegatividad
aumenta de izquierda a derecha. Mientras que en cada grupo, la
electronegatividad aumenta de abajo hacia arriba.
La electronegatividad sirve para
predecir qué tipo de unión química existe entre dos o más átomos. Para ello se
realiza la diferencia de electronegatividad
entre los átomos que participan de la reacción.
Si la diferencia de electronegatividad
entre los átomos de los elementos unidos es mayor o igual a 1,7; el enlace es iónico.
Si la diferencia de electronegatividad
es entre 1,7 y 0,4; el enlace es covalente polar.
Y si la diferencia de electronegatividad
es menor a 0,4; el enlace es covalente no polar.
ACTIVIDADES
A continuación les dejo la actividad que deberá ser presentada la clase siguiente. Haciendo clic en el enlace podrán acceder a ella: PROPIEDADES PERIÓDICAS
Fuentes:





No hay comentarios:
Publicar un comentario